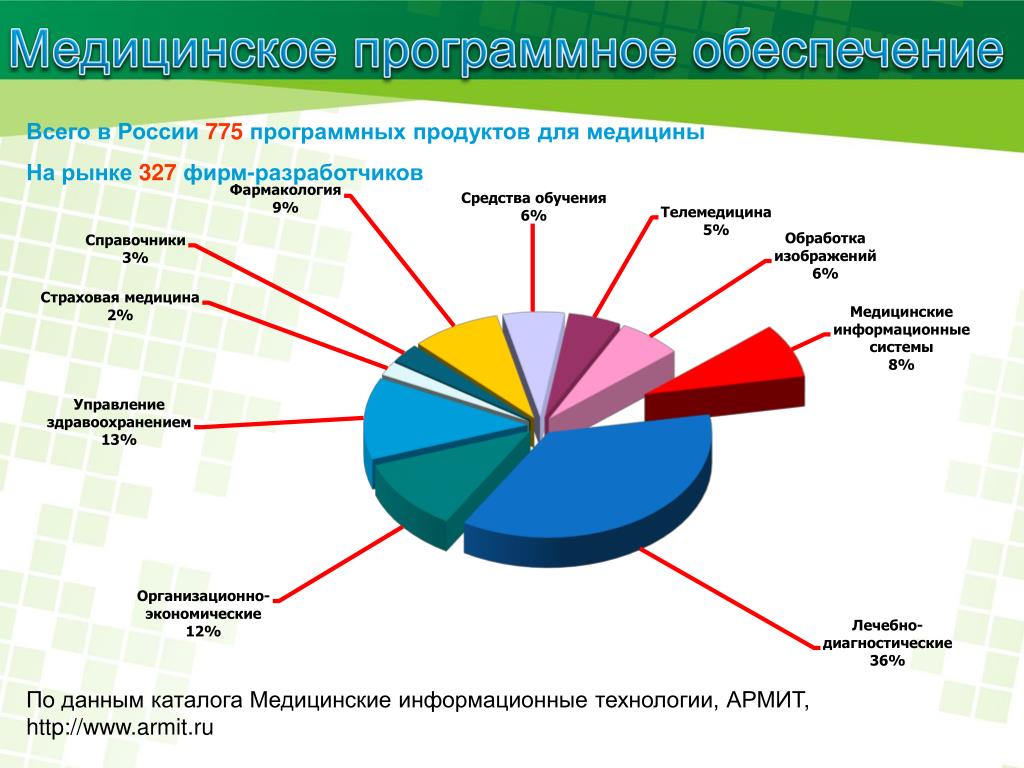
В рамках государственного контракта с ФГБУ «Научный центр экспертизы средств медицинского применения Минздрава РФ» мы приступили к выполнению научно-исследовательских работ «Исследование отечественных программных средств для обеспечения перехода от исследований in vivo к исследованиям in silico в сфере медицинских изделий».
В рамках НИР будет:
- проведен сравнительный анализ по области применения прикладных программных средств (ПС) (не менее 10) отечественного и иностранного производства, используемых в научно-исследовательских целях и представленных на российском рынке (готовый коммерческий продукт), за исключением баз данных (БД), прикладного программного обеспечения (ППО) общего назначения и лабораторных информационных систем (ЛИС), в результате которого сформирована таблица, содержащая, включая, но не ограничиваясь: наименование ПС; назначение ПС; область применения ПС; основные характеристики (совместимость с ОС, разрядность, минимальные требования к системе, возможность работы без доступа к сети); сведения о включении ПС в единый реестр российских программ для электронных вычислительных машин (ЭВМ) и баз данных (для отечественных ПС) или аналогичный реестр (для иностранных ПС); сведения о разработчике (наименование разработчика (производителя) ПС; идентификационный номер налогоплательщика (ИНН) разработчика (производителя) ПС; юридический адрес разработчика (производителя) ПС;ссылка на официальный сайт разработчика (производителя) ПС и /или его официального дистрибьютора (представителя); электронная почта и/ или контактный номер телефона разработчика (производителя) ПС и/или его официального дистрибьютора (представителя)); ссылку на источник (оформленная библиографическая ссылка на электронный ресурс, подтверждающая указанные сведения);
- проведен сравнительный анализ ПС (не менее 3) отечественного производства, планируемых к использованию в научно-исследовательских целях и выводу на российский рынок, находящихся на стадии разработки (прототипа), за исключением БД, ППО общего назначения и ЛИС, в результате которого сформирована таблица, содержащая, включая, но не ограничиваясь: наименование ПС; назначение ПС; область применения ПС; плановую дату выпуска ПС на рынок; сведения о разработчике (наименование разработчика (производителя) ПС; идентификационный номер налогоплательщика (ИНН) разработчика (производителя) ПС;юридический адрес разработчика (производителя) ПС; ссылка на официальный сайт разработчика (производителя) ПС и /или его официального дистрибьютора (представителя);электронная почта и/ или контактный номер телефона разработчика (производителя) ПС и/или его официального дистрибьютора (представителя)); ссылку на источник (оформленная библиографическая ссылка на электронный ресурс, подтверждающая указанные сведения);
- проведен поиск всех действующих на территории Российской Федерации нормативных и методических документов, применимых к ПС, используемым в научно-исследовательских целях, за исключением БД, ППО общего назначения и ЛИС, в результате которого сформирован перечень, содержащий, включая, но не ограничиваясь: наименование нормативного/ методического документа, номер с датой вступления в силу, область применения, ссылку на документ в системе «КонсультантПлюс»;
- проведен поиск всех действующих на территории Российской Федерации нормативных и методических документов, регулирующих область исследований in vivo, в результате которого сформирован перечень, содержащий, включая, но не ограничиваясь: наименование нормативного/ методического документа, номер с датой вступления в силу, область применения, ссылку на документ в системе «КонсультантПлюс»;
- проведен анализ объема (количества) проводимых в российских испытательных и научных лабораториях (центрах) in vivo исследований медицинских изделий за период с 2013 по 2023 гг. с классификацией исследований по цели, области применения и методам, результаты которого сведены в таблицу;
- проведен сравнительный анализ существующих (готовый коммерческий продукт) и разрабатываемых (прототип) решений для исследований in silico (не менее 5) в Российской Федерации, странах Содружества Независимых Государств (СНГ), странах Европейского союза (ЕС), странах Ближнего Востока, странах Азии, странах Африки, странах Северной и Южной Америки, применяемых или потенциально применимых для медицинских целей, в частности в сфере медицинских изделий, в результате которого сформирована таблица, содержащая, включая, но не ограничиваясь: наименование ПС; назначение ПС; область применения ПС;плановую дату выпуска ПС на рынок (при указании прототипа); основные характеристики (совместимость с ОС, разрядность, минимальные требования к системе, возможность работы без доступа к сети); сведения о включении ПС в национальный и/или международный реестр программ для ЭВМ или аналогичный реестр; сведения о разработчике (наименование разработчика (производителя) ПС; ИНН разработчика (производителя) ПС; юридический адрес разработчика (производителя) ПС; ссылка на официальный сайт разработчика (производителя) ПС и /или его официального дистрибьютора (представителя); электронная почта и/ или контактный номер телефона разработчика (производителя) ПС и/или его официального дистрибьютора (представителя)); ссылку на источник (оформленная библиографическая ссылка на электронный ресурс, подтверждающая указанные сведения);
- проведен поиск действующих на территории Российской Федерации, стран СНГ, стран ЕС, стран Ближнего Востока, стран Азии, стран Африки, стран Северной и Южной Америки нормативных и методических документов (не менее 5), регулирующих область исследований in silico, в результате которого сформирован перечень, содержащий, включая, но не ограничиваясь: наименование нормативного/ методического документа, номер с датой вступления в силу, область применения, ссылку на документ в системе «КонсультантПлюс» (для Российской Федерации) или в официальной системе/ базе нормативно-правовых актов соответствующей страны;
- проведена оценка потенциала развития, выраженного в рублевом эквиваленте, рынка ПС для исследований in silico на территории Российской Федерации в период до 2033 года при условии вступления в силу нормативно-правого режима, допускающего проведение исследований in silico взаимен исследований in vivo, в том числе в сфере медицинских изделий, основанная на объеме (количестве) ежегодно проводимых исследований in vivo медицинских изделий и потенциальной доле их замещения исследованиями in silico;
- приведены варианты стимулирования развития рынка ПС для исследований in silicoв сфере медицинских изделий на территории Российской Федерации в виде мер государственной поддержки (с обоснованием), а также варианты нормативного/ методического обеспечения, регулирующего такие ПС и позволяющего реализовать меры государственной поддержки.
Результаты будут опубликованы